Chapter 4 : Buffer Solution
১।
(ক) আয়নীকরণ বিভব কী?
(খ) সার্বাধিক তড়িৎ ঋণাত্মক মৌল – ব্যাখ্যা কর।
(গ)
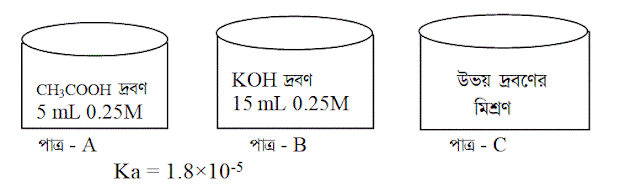
পাত্র - A এর দ্রবণে pH গণনা করো।
(ঘ) উদ্দীপকের C পাত্রের দ্রবণে সামান্য পরিমাণ HCl দ্রবণ যোগ করলে ঐ দ্রবণের pH মানের কোন
পরিবর্তন ঘটবে কী? গাণিতিকভাবে বিশ্লেষণ করো।
১নং প্রশ্নের উত্তর
(ক) গ্যাসীয় অবস্থায় কোন মৌলের এক মোল বিচ্ছিন্ন পরমাণু থেকে এক মোল ইলেকট্রন অসীম
দূরত্বে অপসারণ করে এক মোল ধনাত্মক আয়নে পরিণত করতে যে পরমাণ শক্তির প্রয়োজন হয় তাকে
ঐ মৌলের আয়নিকরণ বিভব বা শক্তি বলে।
(খ) তড়িৎ ঋণাত্মকতাঃ কোন যৌগের অণুতে উপস্থিত দু’টি ভিন্ন পরমাণুর মধ্যে শেয়ারকৃত যুগলকে কোন পরমাণু নিজের
দিকে আকর্ষণ করার ক্ষমতাকে ঐ পরমাণুর তড়িৎঋণাত্মকতা বলে। তড়িৎঋণাত্মকতা মৌলের একটি
পর্যায়বৃত্তিক ধর্ম। এটি মূলত (i)
পরমাণুর আকার (ii) নিউক্লিয়াসের চার্জ ও (iii) বহিস্থ শক্তিস্তরের ইলেকট্রনীয় কাঠাম – এ তিনটি বিষয়ের উপর নর্ভর করে।
পর্যায় সারণির গ্রুপভিত্তিকভাবে গ্রুপ 17 এর সবচেয়ে উপরের মৌল F এবং দ্বিতীয় পর্যায়ের সর্বডানের(নিষ্ক্রিয় গ্যাস ব্যতীত) মৌল F। এ কারণে F আকারে ক্ষুদ্র ও অতীব সক্রিয় মৌল। পর্যায় সারণিতে একই গ্রুপে উপর থেকে নিচের দিকে এবং একই পর্যায়ে ডান থেকে বাম দিকে পরমাণুর আকার বৃদ্ধির সাথে সাথে ঋণাত্মকতা হ্রাস পায়। আবার একই গ্রুপে নিচ থেকে উপরের দিকে এবং একই পর্যায়ে বাম থেকে বাম দিকে পরমাণুর আকার হ্রাসের সাথে সাথে ঋণাত্মকতা বৃদ্ধি পায়। সে কারণে কোন যৌগের অণুতে শেয়ারকৃত ইলেকট্রের উপর F এর নিউক্লিয়াসের আকর্ষণ বল সবচেয়ে বেশি। তাই F এর তড়িৎঋণাত্মকতা সর্বাধিক।
সমীকরণ থেকে দেখা যায়-
5 mL 0.25 M ইথানয়িক এসিড ও 5 mL 0.25M KOH পরষ্পর বিক্রিয়া করে পটাসিয়াম ইথানয়েট লবণ ও পানি উৎপন্ন করে ।
এখানে সম্পূর্ণ
ইথানয়িক এসিড প্রশমিত হবে এবং KOH
কিছু অবশিষ্ট থাকবে।
অবশিষ্ট KOH এর পরিমাণ =( 15 -5) mL = 10 mL
সুতরাং C পাত্রের মিশ্রণটি ক্ষারীয় দ্রবণ।
এখন C পাত্রের মিশ্রণের মোট আয়তন = (5+15) mL = 20 mL
[রাজশাহী,
কুমিল্লা, চট্রগ্রাম , বরিশাল বোর্ড-২০১৮]
(ক) আয়নীকরণ বিভব কী?
(খ)
HNO3 এবং H3PO4 এর মধ্যে কোনটি শক্তিশালী এসিড?
ব্যাখ্যা করো।
(গ) উদ্দীপকের A পাত্রের দ্রবণের pOH হিসাব করো।
(ঘ) উদ্দীপকের B পাত্রের দ্রবণে সামান্য পরিমাণ তীব্র এসিড বা তীব্র ক্ষার যোগ করলে pH মানের কোন হবে কিনা বিশ্লেষণ করো।
২নং প্রশ্নের উত্তর
(ক) গ্যাসীয় অবস্থায় কোন মৌলের এক মোল বিচ্ছিন্ন পরমাণু থেকে এক মোল ইলেকট্রন অসীম
দূরত্বে অপসারণ করে এক মোল ধনাত্মক আয়নে পরিণত করতে যে পরমাণ শক্তির প্রয়োজন হয় তাকে
ঐ মৌলের আয়নিকরণ বিভব বা শক্তি বলে।
(খ) আমরা জানি, অক্সি-এসিডসমূহের মধ্যে যে এসিডের কেন্দ্রীয় পরমাণুর জারণ মান বেশি সেই এসিড বেশি তীব্র। কিন্তু যদি ধনাত্মক জারণ মান সমান হয় তবে যে পরমাণুর আকার ছোট সেই পমাণুবিশিষ্ট এসিডটি বেশি তীব্র। এখানে নাইট্রিক এসিড (HNO3 ) এ N এর জারণ মান +5 এবং ফসফরিক এসিড (H3PO4 ) এ P এর জারণ মানও +5। অর্থাৎ উভয় এসিডের কেন্দ্রীয় পরমাণুর জারণ সংখ্যা সমান। কিন্তু P এর তুলনায় N এর আকার ছোট হওয়ায় নাইট্রোজেনের চার্জ ঘনত্ব বেশি। এ কারণে H3PO4 অপেক্ষা HNO3 অধিক শক্তিশালী।
(ঘ) উদ্দীপকের B পাত্রের ইথানয়িক এসিড ও সোডিয়াম ইথানয়েট লবণের মিশ্রণ একটি
অম্লীয় বাফার দ্রবণ।
আমরা জানি, যে দ্রবণে সামান্য পরিমাণ এসিড বা ক্ষার যোগ করলেও ঐ দ্রবণের pH
পরিবর্তন হয় না তাকে বাফার দ্রবণ বলে।
বাফার দ্রবণে pH
নিয়ন্ত্রনের কৌশল নিম্নে দেখানো হলো-
ইথানয়িক এসিড দূর্বল বলে দ্রবণে সামান্য পরিমাণে আয়নিত হয় এবং সোডিয়াম ইথানয়েট
আয়নিক বলে সম্পূর্ণরূপে আয়নিত হয়।
এই বাফার দ্রবণে সামান্য এসিড বা H+ আয়ন যোগ করলে এই আয়ন দ্রবণে উপস্থিত ইথানয়েট বা অ্যাসিটেট আয়নের
(CH3 COO-) সাথে
বিক্রিয়া করে ইথানয়িক এসিড বা অ্যাসিটিক এসিডে পরিণত হয়।

সামান্য ক্ষার (OH- )
যোগ করলেঃ
পাত্রের দ্রবণে সামান্য ক্ষার বা OH- আয়ন যোগ করলে তা দ্রবণে উপস্থিত H+ আয়নের সাথে বিক্রিয়া করে পানি
উৎপন্ন করে।
যখন এই বিক্রিয়া ঘটে তখন এসিড বিয়োজিত হয়ে বিক্রিয়ারত আয়নের
অভাব পূরণ করে। এভাবে OH- আয়ন H+ আয়ন দ্বারা প্রশমিত
হওয়ার ফলে দ্রবণে OH- আয়নের
ঘনমাত্রা বৃদ্ধি না পেয়ে অপরিবর্তিত থাকে। ফলে দ্রবণের PH এর
মান অপরিবর্তিত থাকে।
অতএব, B পাত্রের
দ্রবণে সামান্য পরিমাণ তীব্র এসিড বা তীব্র ক্ষার যোগ করা হলেও
উল্লেখিত কৌশলের মাধ্যমে pH মান অপরিবর্তিত থাকে।
ঢাকা বোর্ডঃ ২০১৭
(ক) হেসের সূত্রটি লেখো ।
(খ) তীব্র এসিড ও তীব্র ক্ষারের প্রশমন তাপ ধ্রুবক কেন?
(গ) উদ্দীপকের P দ্রবণের ধনাত্মক মূলক সনাক্তকরণ সমীকরণসহ বর্ণনা করো।
(ঘ) M পাত্রের দ্রবণে সামান্য পরিমাণ তীব্র এসিড বা তীব্র ক্ষার যোগ করলে দ্রবণের pH এর মানের কোন পরিবর্তন হবে কী? বিশ্লেষণ কর।
৩নং প্রশ্নের উত্তর
(ক)
হেসের সূত্রঃ কোন বিক্রিয়ায় বিক্রিয়ক ও উৎপাদ যদি
স্থির থাকে তবে বিক্রিয়াটি একধাপে ঘটুক বা একাধিক ধাপে ঘটুক না কেন, প্রতিক্ষেত্রেই তাপ শক্তির পরিবর্তন সমান হবে।
(খ) এসিড ও
ক্ষারের বিক্রিয়ায় 1 মোল পানি উৎপন্ন করতে যে পরিমাণ তাপ
উৎপন্ন হয় তাকে প্রশমন তাপ বলে। এসিড ও ক্ষারের বিক্রিয়া হল প্রশমন বিক্রিয়া। এ
বিক্রিয়ায় সর্বদা তাপ উৎপন্ন হয় এবং তীব্র এসিড ও তীব্র ক্ষারের প্রশমন তাপের মান -57.34 kJ/mol।
যেমন তীব্র এসিড HCl ও তীব্র ক্ষার NaOH এর প্রশমন বিক্রিয়াকে নিম্নরূপে দেখানো যায়ঃ
এখানে তীব্র এসিড ও তীব্র ক্ষার সম্পূর্ণরূপে আয়নিত হয়। উৎপন্ন H+ আয়ন ও OH- আয়ন পরষ্পরের সাথে বিক্রিয়া করে পানি উত্পন্ন করে এবং 57.34 kJ তাপ উত্পন্ন করে। কিন্তু দ্রবণে উপস্থিত Na+ ও Cl- আয়নদ্বয় বিক্রিয়ায় অংশগ্রহণ করে না। এদেরকে দর্শক আয়ন বলে। যেহেতু সকল তীব্র এসিড ও তীব্র ক্ষারের মধ্যে একই বিক্রিয়া ঘটে, অর্থাৎ H+ আয়ন ও OH- আয়ন পরষ্পর যুক্ত হয়ে পানি এবং একই পরিমাণ তাপ শক্তি উত্পন্ন করে। সেহেতু সকল তীব্র এসিড ও তীব্র ক্ষারের প্রশমন তাপ একই এবং এর মান -57.34 kJ/mol ।
1M 0.015 mL NH4OH ক্ষার
দ্রবণ ও 1 M 0.015 mL HCl দ্রবণ বিক্রিয়া করে NH4Cl লবণ ও পানি উৎপন্ন করে ।
অবশিষ্ট ক্ষারের পরিমাণ =( 5 -0.015) mL = 4.985 mL
সুতরাং R পাত্রে
ক্ষার ও লবণের মিশ্রণটি একটি ক্ষারীয় বাফার।
আমরা জানি, বাফার দ্রবণে সামান্য পরিমাণ এসিড বা ক্ষার যোগ করলেও ঐ দ্রবোনের pH পরিবর্তন হয় না।
বাফার দ্রবণে pH নিয়ন্ত্রনের কৌশল নিম্নে দেখানো হলো-
দ্রবণে দূর্বল ক্ষার সামান্য পরিমাণে আয়নিত হয় এবং লবণ সম্পূর্ণরূপে আয়নিত হয়।
R পাত্রে সামান্য এসিড যোগ করলে এসিডের H+ আয়ন দ্রবণে উপস্থিত হাইড্রোক্সিল আয়নের (OH- ) সাথে বিক্রিয়া করে পানি উৎপন্ন করে। যখন এ বিক্রিয়া ঘটে তখন অবিয়োজিত ক্ষার কিছুটা বিয়োজিত হয়ে OH- আয়নের অভাব পূরণ করে।
দ্রবণে সামান্য ক্ষার যোগ করলেঃ
উদ্দীপকের মিশ্রণে সামান্য ক্ষার বা OH- আয়ন যোগ করলে তা দ্রবণে উপস্থিত NH4+ আয়নের সাথে বিক্রিয়া করে NH4OH উৎপন্ন করে।











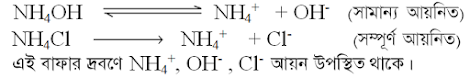
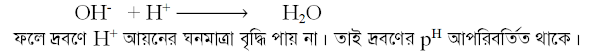




কোন মন্তব্য নেই